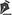RESUMO
OBJETIVO: Caracterizar a pele de tilápia do Nilo, uma possível fonte de biomaterial para enxertia, a partir de suas características físicas (resistência à traçao), histomorfológicas e da tipificaçao da composiçao do colágeno.
MÉTODOS: Amostras de pele de tilápia do Nilo foram utilizadas e, para os testes de traçao (utilizando a máquina de ensaios universais Instron®), as peles foram submetidas à imersao em soluçoes de glicerol em crescente concentraçao. Parte das amostras foi fixada em formol neutro a 10%, processada e corada com o uso da hematoxilina e da eosina, para confecçao de lâminas e posterior análise histológica e histoquímica. Todas as etapas foram reproduzidas também em pele humana, doada de cirurgias plásticas, para efeito comparativo.
RESULTADOS: A morfologia da pele da tilápia mostrou-se semelhante à da pele humana, com derme profunda formada por espessas fibras colágenas organizadas, em disposiçao paralela/horizontal e transversal/vertical. A pele de tilápia também apresentou maior composiçao por colágeno tipo I em relaçao à pele humana (p=0,015). Nos testes de traçao, a carga média suportada pela pele de tilápia foi de 43,9±26,2 N, enquanto a extensao à traçao teve valores médios de 4,4±1,045 cm
CONCLUSAO: A pele de tilápia possui características microscópicas semelhantes à estrutura morfológica da pele humana e elevada resistência e extensao à traçao em quebra, o que suporta sua possível aplicaçao como biomaterial. A derme desta pele é composta por feixes organizados de fibras de colágeno denso, predominantemente do tipo I, o que traz considerável importância para seu uso clínico.
Palavras-chave:
Materiais Biocompatíveis. Colágeno. Tilápia.
ABSTRACT
OBJECTIVE: To characterize the Nile tilapia skin, a possible source of biomaterial for grafting, from their physical (tensile strength) and histomorphological characteristics, and from collagen classification.
METHODS: Samples of Nile tilapia skin were used and, for microtensile tests (by Instron® universal testing machine), were subjected to immersion in glycerol solutions of increasing concentration. Part of the samples was fixed in neutral formalin 10%, processed and prepared using routine staining with hematoxylin and eosin into tissue slides, for further histological and histochemical analysis. All steps were also played in human skin, donated by plastic surgeries, for comparative effects.
RESULTS: The morphology of Nile tilapia skin presented similarities with human skin, showing the deep dermis formed by thick organized collagen fibers, on parallel/horizontal and transversal/vertical arrangement. The tilapia skin also presented a larger composition of type I collagen, compared with human skin (p=0.015). On traction tests, the load average supported by tilapia skin was 43.9±26.2 N, while the traction extensile had mean values of 4.44±1.045cm.
CONCLUSION: The tilapia skin has microscopic characteristics, similar to the morphological structure of human skin, and high resistance and tensile extension at break, which supports its possible application as biomaterial. The dermis of this skin is composed by organized bundles of dense collagen fibers, predominantly type I ones, which brings considerable importance for its clinical use.
Keywords:
Biocompatible Materials. Collagen. Tilapia.
INTRODUÇAOA queimadura é uma das maiores agressoes que o nosso organismo pode sofrer. Ela varia desde uma simples insolaçao, queimadura de primeiro grau, até a destruiçao total da pele (epiderme e derme) e dos tecidos adjacentes, como nas queimaduras de terceiro grau, causadas pelo choque elétrico. A maioria da populaçao atingida pelas queimaduras é de baixa renda e 97% nao tem nenhum plano de saúde
1.
Nas lesoes de 2º e de 3º graus, com grande superfície corporal (SCQ) atingida, o tratamento é feito por uma equipe interdisciplinar. O paciente fica internado em um centro de tratamento de queimados. O tratamento clínico inclui reposiçao hídrica adequada, através de uma veia de grande calibre, controle da diurese (por meio de sonda vesical), suporte enteral (via sonda nasogástrica ou enteral), para evitar a hemorragia digestiva e a translocaçao bacteriana, boa analgesia horária e, em alguns casos, antibioticoterapia. O tratamento cirúrgico vai desde os curativos, passando pela escarotomia e pela fasciotomia, pelos desbridamentos, pelas amputaçoes, pelos enxertos, pelos retalhos fasciocutâneos, até os retalhos livres
2.
Em nosso país, em todos os centros de tratamento de queimados da rede pública, temos a seguinte conduta, em relaçao aos curativos: nas queimaduras de segundo grau, é realizado diariamente o banho com clorexidine a 2% e o curativo é feito com o antimicrobiano tópico sulfadiazina de prata a 1%, até a completa reparaçao da lesao (2º grau superficial em torno de 12 dias e profundo entre 21 e 25 dias); nas lesoes de terceiro grau, é realizado o desbridamento do tecido necrótico em várias etapas (desbridamento sequencial), feito o curativo com sulfadiazina de prata a 1%, até a preparaçao do leito da ferida para a enxertia.
Na rede privada, em nosso país, este cenário se modifica e, dependendo do tipo de convênio ou das condiçoes financeiras do paciente, sao usados curativos biossintéticos e peles artificiais, todos importados e de elevado custo. Na Europa e nos Estados Unidos da América, sao utilizadas, nestas lesoes de 2º e de 3º graus, peles homólogas (pelos inúmeros bancos de pele), peles heterólogas, curativos biossintéticos e derme artificial, para melhor sobrevida e boa recuperaçao funcional. Infelizmente, em um país com as dimensoes do Brasil, temos apenas em funcionamento dois bancos de pele, sendo um em Sao Paulo (Hospital das Clínicas) e o outro em Porto Alegre (Santa Casa de Misericórdia), uma vez que o único banco do Nordeste, localizado em Recife (Instituto de Medicina Integral Professor Fernando Figueira - IMIP), encontra-se desativado
3.
Estamos muito distantes de ter o substituto cutâneo temporário ideal. Alguns curativos heterólogos já foram testados e usados em nosso país, porém abandonados ao longo do tempo, seja pelo elevado custo de importaçao, como a pele porcina, ou pela falta de estudos científicos, como a pele de ra ou pela transmissao de doenças animais, que todos podem causar, a nao ser quando a pele é irradiada, aumentando os custos
4.
Tecidos biológicos de origem animal, como a pele de porco, a pele de ra, o pericárdio bovino e a camada submucosa de intestino de porco, têm sido utilizados em curativos oclusivos biológicos (heteroenxertos), nas lesoes por queimaduras
5-9.
Entretanto, para a liberaçao e a utilizaçao desses materiais, eles devem ser submetidos a rigorosos protocolos, para a identificaçao da sua real contribuiçao, eficácia e biocompatibilidade
10.
A pele da tilápia do Nilo surge como um possível subproduto, com aplicabilidade clínica de novos biomateriais utilizáveis para a bioengenharia. A tilápia do Nilo (
Oreochromis niloticus), pertencente à família dos ciclídeos, é originária da bacia do rio Nilo, no Leste da Africa, encontrando-se amplamente disseminada nas regioes tropicais e subtropicais. No Ceará, a piscicultura da tilápia encontra-se difundida em diversos reservatórios, nas principais bacias hidrográficas do Estado, sendo o açude Castanhao, localizado nos municípios de Jaguaribara, Alto Santo, Jaguaribe e Jaguaretama, seu principal produtor. A pele deste peixe é um produto nobre e de alta qualidade, pois possui resistência peculiar, couro
11. Entretanto, nao existem estudos que evidenciem sua resistência como pele nao submetida ao curtimento.
Estudos histológicos da pele da tilápia demonstraram uma epiderme revestida por um epitélio pavimentoso estratificado, seguido de extensas camadas de colágeno
12. O colágeno configura-se como um dos principais componentes dos biomateriais, devido à sua característica de orientar e de definir a maioria dos tecidos
13, além de possibilitar biodegradabilidade e biocompatibilidade, que favorecem a sua aplicaçao
14. Desta forma, o detalhamento da quantidade e o tipo de colágeno presente configuram-se como formas de caracterizaçao de biomateriais.
A literatura reporta poucos trabalhos em que a pele de tilápia foi submetida ao processo de curtimento para confecçao de luvas e de vestimentas. Testes mecânicos de tracionamento sao descritos, conferindo o aproveitamento deste material, apesar da sua delgada espessura para este fim
11. No entanto, ainda nao existem trabalhos publicados sobre a possibilidade de utilizaçao desta pele como biomaterial, para recobrimento de feridas na pele humana por queimadura.
Dessa forma, esse estudo objetivou a caracterizaçao da pele de tilápia do Nilo, a partir de suas características histomorfológicas, tipificaçao do colágeno e características físicas (resistência à traçao). O método de processamento, de descontaminaçao e de esterilizaçao da pele da tilápia e sua aplicaçao em queimaduras e feridas foi registrado no Instituto Nacional da Propriedade Industrial (INPI) com o número BR1020150214359.
MÉTODOAmostras de pele de tilápia do Nilo (
Oreochromis niloticus) (n=7) foram obtidas através da piscicultura do Castanhao (Jaguaribara-CE). Os peixes sao cultivados em tanque de rede, com peso entre 800 e 1000 g. Eles foram insensibilizados por choque térmico (caixas isotérmicas com gelo moído e água [1:1]), para, em seguida, realizar-se a sangria. As peles foram removidas com uma turquesa (ferramenta) e submetidas à lavagem com água corrente, para remoçao de qualquer resquício de sangue e de outras impurezas. Posteriormente, foram colocadas em soluçao fisiológica NaCl a 0,9% estéril (previamente resfriada a 4ºC) para a limpeza final. As peles para os testes de microtraçao foram submetidas a um processo de esterilizaçao, que consta de duas etapas de imersao em clorexidina por 30 minutos e três etapas de imersao no glicerol (50%, 75%, 100%). As peles utilizadas para análise histológica e histoquímica foram armazenadas em soluçao de formol tamponado a 10%.
Adicionalmente, amostras de pele humana de descarte, oriundas de cirurgias estéticas, foram armazenadas em soluçao de formol tamponado a 10% para análise histológica e histoquímica. Paralelamente, outras amostras foram submetidas aos testes de microtraçao e passaram pelas mesmas etapas de esterilizaçao que a pele da tilápia. Destaca-se, ainda, que estas peles humanas foram utilizadas apenas em laboratório, nao sendo realizada nenhuma intervençao terapêutica nas mesmas.
Análise HistológicaApós o período de fixaçao, as amostras foram analisadas macroscopicamente e clivadas para remoçao de tecidos muscular e adiposo excedentes. Em seguida, os fragmentos foram processados em processador automático de tecidos (Lupe
®), incluídos em parafina fundida a 58ºC e seccionados em micrótomo semiautomático Leica
®, com cortes de 4 µm de espessura. As lâminas histológicas foram coradas com hematoxilina-eosina
15 e analisadas com o auxílio de microscópio óptico.
Análise HistoquímicaCortes de 3µm foram dispostos em lâminas de vidro e desparafinizadas em estufa a 60ºC por 3h, seguidos de três banhos de xilol (5 minutos cada). Após reidrataçao em série decrescente de álcool, as lâminas foram incubadas em soluçao de picrosirius red (ScyTek
®) por 30 minutos e lavadas rapidamente em dois banhos de ácido clorídrico 5%, contracorados com hematoxilina de Harris por 45 segundos e montadas com Enhtellan
®. As lâminas foram analisadas em microscópio de luz polarizada (Leica
® modelo DM 2000), o que permite visualizar o colágeno tipo I (maduro), com coloraçao vermelho-alaranjada, e o colágeno tipo III (imaturo), com cor verde.
Para quantificaçao dos diferentes tipos de colágeno, seis campos em um aumento de 200x foram fotografados com uso de câmera DFC 295, acoplada ao Microscópio Leica
® DM 2000. As fotomicrografias foram avaliadas pelo
software de análise de imagem Image J
® (RSB), após calibraçao das imagens pelo comando Color Thershold (Image > Adjust > Color Thersold) na funçao RGB, para as cores Vermelho (Mínimo de 71 e Máximo de 255), Verde (Mínimo de 0 e Máximo de 69) e Azul (Mínimo de 0 e Máximo de 92).
Depois da calibraçao, as imagens foram convertidas para a escala de cor de 8-bits (Image > Type > 8-bit), binarizadas (Process > Binary > Make Binary) e foi mensurada a porcentagem de área de colágeno marcada em vermelho (Analyse > Analyse Particles). Após a polarizaçao de luz, o mesmo protocolo foi realizado, ajustando-se as cores na funçao RGB para Vermelho (Mínimo de 0 e Máximo de 255), Verde (Mínimo de 0 e Máximo de 255) e Azul (Mínimo de 0 e Máximo de 32).
Após ajuste, as imagens foram convertidas para a escala de cor de 8-bits (Image > Type > 8-bit), binarizadas (Process > Binary > Make Binary), e foi mensurada a porcentagem de área de colágeno marcada em amarelo-avermelhado (correspondente ao colágeno tipo I). Em seguida, do total da área marcada em vermelho, foi separado um percentual da regiao ocupada somente pela marcaçao amarelo-avermelhada. A área verde-esbranquiçada, relativa ao colágeno tipo III, foi obtida pela subtraçao da regiao total marcada em vermelho e o percentual marcado unicamente pela cor amarelo-avermelhada
16.
Os dados foram submetidos ao teste de normalidade de Kolmogorov-Smirnov e comparados por meio do teste t de Student [nível de significância: 5%, dados paramétricos descritos na forma: média ± erro-padrao da média (EPM)].
Testes de TraçaoOs ensaios de traçao foram realizados no equipamento Instron
® 3345 com célula de carga de 50N, no módulo de traçao, utilizando-se garras de açao mecânica em cunha (Figura 1).

Figura 1 - Corpo de prova de pele de tilápia montado em Single Column Universal Testing Systems for Capacity Testing up to 5 kN Instron
® 3345, no módulo de traçao.
Todas as amostras (pele de tilápia e humana) foram reidratadas com soluçao fisiológica NaCl 0,9% (3 lavagens de 5 minutos) e cortadas, obtendo-se 26 corpos de prova de formato retangular, medindo 10,0 x 2,0 cm, sendo 17 da pele da tilápia e nove de pele humana. Em seguida, foram realizados cortes adicionais, a fim de proporcionar-lhes uma conformaçao de ampulheta, cujo centro apresentava 1,0 cm de largura (Figura 2). No momento do teste, a espessura de cada corpo de prova foi aferida, referente à regiao do centro da ampulheta, utilizando-se um paquímetro digital Mitutoyo
®.

Figura 2 - Corpo de prova para o ensaio de tracionamento medindo 10,0 x 2,0 cm (altura x largura) mostrando regiao central em forma de ampulheta com 1,0 cm de largura.
Em cada ensaio, um corpo de prova foi posicionado entre as garras e, com o uso do
software Bluehill 2
®, foram mensuradas a carga máxima observada (N), a deformaçao à traçao em máximo de carga (%), a carga em quebra (N) e o esforço à traçao em quebra (N/mm
2), além da extensao à traçao em máximo de carga (cm). Todos os ensaios foram realizados com uma velocidade de deslocamento de 5 mm/min.
RESULTADOS
Análise Histológica
Pele de tilápiaA análise microscópica da pele de tilápia demonstrou a epiderme revestida por epitélio pavimentoso estratificado constituído, em diversos trechos, por poucas camadas celulares. As células basais apresentavam morfologia colunar e as espinhosas, poligonais com núcleos ovais. Foram observadas células mucosas dispersas (Figura 3A).
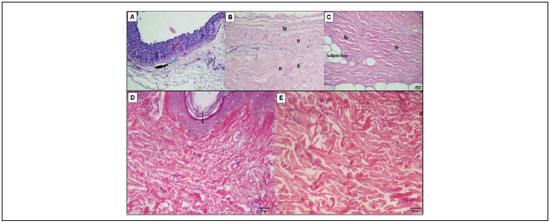
Figura 3 - Fotomicrografia de pele de tilápia (A, B e C) e pele humana (D e E). A. Epiderme (seta vermelha) e derme superficial (seta verde) com melanóforos subepiteliais (seta azul) (HE, 100x); B. Derme profunda mostrando fibras colágenas transversais (ft) (HE, 200x); C. Fibras colágenas paralelas (fp) na derme profunda e trecho de hipoderme com depósitos de adipócitos (HE, 400x); D. Epitélio pavimentoso estratificado hiperorceratinizado sob o qual há córion fibroso denso (seta preta) (HE, 200x); E. Regiao de derme profunda de pele humana exibindo fibras colágenas em diferentes direçoes (HE, 400x).
A derme superficial era composta por tecido conjuntivo frouxo, permeado por vasos sanguíneos de calibres variados, com fibras colágenas paralelas e finas, além de melanóforos subepiteliais e melanofagos dispersos (Figura 3A). Na derme profunda, observaram-se espessas fibras colágenas organizadas, compactadas, em disposiçao paralela/horizontal e transversal/vertical, perpendiculares à superfície da pele (Figura 3B).
Acúmulos de adipócitos típicos e feixes nervosos foram evidenciados na hipoderme (Figura 3C).
Pele humanaFragmentos de pele humana foram analisados sob microscopia ótica, que revelou um revestimento de epitélio pavimentoso estratificado hiperortoparaqueratinizado, com trechos de atrofia, sob o qual se visualizava tecido conjuntivo fibroso, com aumentada atividade colagênica, células inflamatórias mononucleares dispersas e vasos sanguíneos, por vezes, dilatados (Figura 3D).
Na derme superficial e na profunda, havia tecido conjuntivo fibroso denso nao modelado, com as fibras colágenas dispostas em diferentes direçoes (Figura 3E).
Análise HistoquímicaFoi considerado, para esta análise, o colágeno da derme profunda da pele da tilápia, visto que, na derme superficial, o tecido conjuntivo era disposto frouxamente com poucas fibras colágenas. Como na pele humana nao foi visualizada esta diferença, pois tanto a derme superficial como a profunda apresentavam tecido conjuntivo fibroso denso, o colágeno analisado pertencia às duas regioes.
Os fragmentos avaliados da pele da tilápia e da humana revelaram extensa área preenchida por colágeno, representando 91,6±1,1% (média±EPM) e 71,3±2,6% (média±EPM), respectivamente (p<0,001) (Figura 4A). A análise quantitativa do colágeno demonstrou que, na pele de tilápia, houve maior percentual de área preenchida por colágeno tipo I (maduro) (área marcada em laranja/vermelho) [52,2±3,0% (média±EPM)], do que o observado na pele humana, na qual a área ocupada por este tipo de colágeno foi 39,2±2,4% (média±EPM), revelando diferença estatística entre os grupos (
p=0,015) (Figuras 4B e 5). Por outro lado, o percentual de colágeno tipo III (imaturo) (área marcada em amarelo/verde) mostrou-se significativamente superior na pele humana [60,8±2,4% (média±EPM)] em relaçao à pele da tilápia [47,8±3,0% (média±EPM)] (
p=0,015) (Figuras 4C e 5).
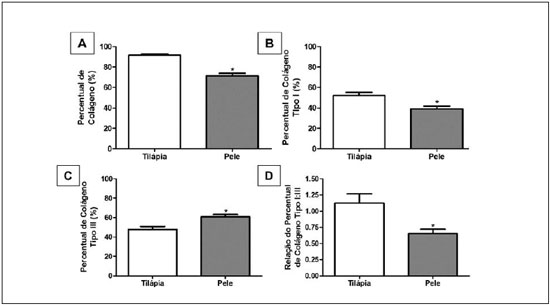
Figura 4 - Avaliaçao do percentual da área preenchida por colágeno e os diferentes tipos de colágeno (I e III) em tecido conjuntivo de tilápia e humano. *p<0.05, teste t de Student (média ± EPM).
Figura 5 - Perfil de colágeno da pele de tilápia (A e B) e pele humana (C e D) sem (A e C) e com (B e D) polarizaçao de luz (Picrosirius Red, 400x), mostrando a distribuiçao de colágeno tipo I (amarelo-avermelhado) e tipo III (verde-esbranquiçado). Seta preta: colágeno tipo I. Seta azul: colágeno tipo III.
A razao entre a quantidade de colágeno tipo I:III mostrou-se significantemente aumentada na tilápia [1,12±0,15 (média±EPM)], em relaçao ao encontrado na pele humana [0,65±0,06 (média±EPM)] (
p=0,029) (Figura 4D).
Testes de Traçao
Pele da tilápiaA ruptura de todos os corpos de prova da pele de tilápia ocorreu na regiao do centro da ampulheta, onde a espessura variou de 0,66 a 0,96 mm.
Para a análise de carga máxima (N), a qual avalia a carga que a pele suporta sem ocorrer quebra, obtiveram-se o valor maior de 94,013 N e o menor de 15,763 N. A média deste parâmetro ficou em 43,967±26,248 N (média±EPM). Com relaçao à avaliaçao da extensao à traçao em máximo de carga medida em centímetros (cm), a pele da tilápia suportou uma deformaçao que variou entre 6,45 a 2,74 centímetros (média = 4,442±1,045 cm), sem sofrer quebra.
O teste de deformaçao à traçao em máxima carga (%) resultou em valores de 62,775% (máximo), de 25,908% (mínimo) e média de 42,529±10,342 %.
A prova de carga em quebra (N) demonstrou ampla variaçao, visto que os resultados da pele da tilápia oscilaram de um valor máximo de 68,394 N até um mínimo de 4,828 N (média = 22,727±15,673N).
Os valores de esforço à traçao em quebra (N/mm
2) resultaram em um máximo de 22,393 N/mm
2 e mínimo de 0,704 N/mm
2 (média = 4,964±5,236 N/mm
2) (Tabela 1).
Pele humanaNove amostras de pele humana foram submetidas à avaliaçao de propriedades físicas através de testes de traçao. Os mesmos parâmetros foram avaliados, e os dados obtidos estao resumidos no quadro acima (Tabela 2).
A extensao à traçao em quebra medida em centímetros apresentou média de 4,615 cm, valor semelhante ao encontrado na análise da pele da tilápia.
DISCUSSAOSobre a análise histológica, os achados do presente estudo foram semelhantes aos encontrados previamente na literatura, em que foi descrito que a pele da tilápia é composta por epiderme representada por epitélio pavimentoso estratificado, com células basais cúbicas ou cilíndricas de núcleo oval e com a possível presença de células mucosas
11. A derme, por sua vez, é constituída por tecido conjuntivo frouxo (superficial) e denso (profundo). Na camada mais externa da derme profunda, já foram mostradas, também, fibras colágenas horizontais e verticais (perpendiculares à superfície da pele), e na interna, fibras horizontais compactadas e espessas, corroborando os nossos achados
12. Estudos prévios também evidenciaram, como nesta pesquisa, melanóforos em derme superficial
11.
A família do colágeno é composta por mais de 20 tipos geneticamente diferentes, sendo os mais frequentemente encontrados na derme os tipos I, II, III, IV VI, VII. O colágeno tipo I forma fibras espessas, mecanicamente estáveis e responsáveis pela resistência do tecido às forças de tensao. O colágeno tipo III forma fibrilas, geralmente presentes logo abaixo da membrana basal, e participa da fixaçao da epiderme à derme. O colágeno tipo I é o mais comum, estando presente em estruturas rígidas como tendoes, ossos e cartilagens, enquanto o tipo III está em abundância em órgaos relacionados com elasticidade, como pulmao e vasos sanguíneos
17,18.
A diferenciaçao entre os tipos de colágeno configura-se como um exercício difícil, sendo uma das técnicas mais executáveis a coloraçao histoquímica de Picrossirius Red, seguida da técnica de polarizaçao da luz, realizada neste estudo, a qual confere diferenciaçao entre colágenos I e III, sendo essa a justificativa para a análise mais específica desses dois tipos
19.
A maioria dos biomateriais, como pericárdio de porco, apresenta grande quantidade de colágeno tipo I (47%)
20, do mesmo modo que a pele de tilápia (57%, no presente estudo). Sugere-se que este tipo de colágeno possua grande quantidade de grupos reativos, como aminas, ácidos carboxílicos e hidroxilas alcoólicas, que possibilitam alteraçoes químicas do tecido, principalmente através de reaçoes de reticulaçao e hidrólise seletiva
21, aumentando sua adaptaçao aos outros tecidos.
A estrutura do colágeno tipo I é caracterizada por um tripeptídeo, no qual há, frequentemente, glicina, prolina e hidroxiprolina. Apesar de a composiçao por aminoácidos variar de acordo com as espécies, em geral, animais marinhos contêm menor quantidade de hidroxiprolina compondo o colágeno tipo I, o que está diretamente relacionado com a temperatura de degradaçao dessa estrutura. A temperatura corporal dos mamíferos é, nesse caso, superior à temperatura de degradaçao do colágeno, o que, por conseguinte, limita seu uso na medicina regenerativa; no entanto, o colágeno tipo I de peixes tropicais, como a tilápia, possui uma temperatura de degradaçao superior, comparada aos outros peixes. Estudos mostram que, nesse aspecto, o colágeno tipo I derivado da tilápia possui um grande potencial de uso clínico, podendo ser comparado, inclusive, aos materiais em utilizaçao, derivados de mamíferos. O colágeno obtido da pele da tilápia é, ainda, uma opçao mais rentável e estável, comparada à obtençao através das escamas
22.
Os feixes de colágeno denso da pele da tilápia sao dispostos, predominantemente, de forma paralela e transversal, diferindo da organizaçao da derme humana, em que se encontram fibras com aumentada atividade colagênica em direçoes diversas. Esses aspectos poderiam contribuir para o entendimento da alta capacidade da pele humana em resistir a grandes cargas, no entanto, esta diferença no arranjo das fibras colágenas nao parece interferir no parâmetro da elasticidade da pele da tilápia, visto que os valores encontrados em ambas as peles no teste de extensao à traçao, medida em centímetros, apresentaram médias semelhantes (média tilápia = 4,442 cm; média humana = 4,615 cm). Esta característica possibilitaria satisfatória manipulaçao da pele do peixe nas manobras de recobrimento e sutura, por exemplo.
Os ensaios de resistência à traçao se prestam para se verificar qual a tensao máxima que as membranas suportam até que ocorra sua ruptura, ou seja, para avaliar a capacidade da pele em absorver as cargas impostas, sendo essas informaçoes essenciais para sua possível utilizaçao como matrizes na área de regeneraçao tecidual, onde estao sujeitas à carga.
Em relaçao aos valores encontrados nos testes de traçao, poucas sao as pesquisas reportadas na literatura que apresentam metodologia semelhante à deste estudo. Em avaliaçao prévia com peritônio de paca, um possível biomaterial de uso clínico, armazenadas em glicerol 98%, em períodos de até 30 dias, evidenciaram-se valores médios de carga máxima (16 N) e esforço a traçao (2,8 N/mm
2), inferiores ao encontrado para a pele de tilápia em teste, entretanto, com valores de deformaçao ligeiramente superiores (49%)
23.
Quando comparados com a pele de tilápia submetida ao curtimento, os valores encontrados na literatura sao em média superiores, como esperado, em que a pele curtida apresenta valores de carga máxima de 112 N, esforço à traçao de 10,87 N/mm
2 e deformaçao de 75%
24.
CONCLUSAOÉ possível a utilizaçao da pele da tilápia como promissor biomaterial na medicina regenerativa. As suas características microscópicas, semelhantes à estrutura morfológica da pele humana e elevada resistência e extensao à traçao em quebra possibilitam esta aplicaçao. A derme desta pele é composta por feixes de colágeno compactados, longos e organizados, predominantemente do tipo I, de considerável importância para seu uso clínico. No entanto, novos estudos sao necessários, particularmente em animais, para validaçao da pele da tilápia como curativo biológico temporário em queimaduras.
REFERENCIAS1. Lima Júnior EM. Rotina de atendimento ao queimado. Fortaleza: Gráfica LCR; 2009.
2. Crisóstomo MR, Serra MCVF, Gomes RD. Epidemiologia das queimaduras. In: Lima Júnior EM, Serra MC, eds. Tratado de queimaduras. Sao Paulo: Atheneu; 2004. p.31-5.
3. Lima Júnior EM, Novaes FN, Piccolo NS, Serra MCVF. Tratado de queimaduras no paciente agudo. Sao Paulo: Atheneu; 2008.
4. Bolgiani A, Lima Júnior EM, Serra MCVF. Quemaduras - Conductas Clínicas y Quirúrgicas. Rio de Janeiro: Atheneu; 2013.
5. Kua EH, Goh CQ, Ting Y, Chua A, Song C. Comparing the use of glycerol preserved and cryopreserved allogenic skin for the treatment of severe burns: differences in clinical outcomes and in vitro tissue viability. Cell Tissue Bank. 2012;13(2):269-79.
6. Haslam IS, Roubos EW, Mangoni ML, Yoshizato K, Vaudry H, Kloepper JE, et al. From frog integument to human skin: dermatological perspectives from frog skin biology. Biol Rev Camb Philos Soc. 2014;89(3):618-55.
7. Leto Barone AA, Mastroianni M, Farkash EA, Mallard C, Albritton A, Torabi R, et al. Genetically modified porcine split-thickness skin grafts as an alternative to allograft for provision of temporary wound coverage: preliminary characterization. Burns. 2015;41(3):565-74.
8. Zaidi AH, Nathan M, Emani S, Baird C, del Nido PJ, Gauvreau K, et al. Preliminary experience with porcine intestinal submucosa (CorMatrix) for valve reconstruction in congenital heart disease: histologic evaluation of explanted valves. J Thorac Cardiovasc Surg. 2014;148(5):2216-4.
9. Gubitosi A, Docimo G, Parmeggiani D, Pirozzi R, Vitiello C, Schettino P, et al. Acellular bovine pericardium dermal matrix in immediate breast reconstruction after Skin Sparing Mastectomy. Int J Surg. 2014;12 Suppl 1:S205-8.
10. Piccolo M, Piccolo N, Daher R, Daher S. Cicatrizaçao e Cicatrizes. In: Lima Júnior EM, Novaes FN, Piccolo N, Serra MCVF. Tratado de Queimaduras no Paciente Agudo. 2a ed. Sao Paulo: Atheneu; 2009. p.591-607.
11. Franco MLRS, Franco NP, Gasparino E, Dorado DM, Prado M, Vesco APD. Comparaçao das peles de tilápia do Nilo, pacu e tambaqui: histologia, composiçao e resistência. Arch Zootec. 2013;62 (237):21-32.
12. Souza MLR, Santos HSL. Análise morfológica da pele da tilápia do Nilo (Oreochromis niloticus) através da microscopia de luz. Rev Unimar. 1997;19(3):881-8.
13. Cen L, Liu W, Cui L, Zhang W, Cao Y. Collagen tissue engineering: development of novel biomaterials and applications. Pediatr Res. 2008;63(5):492-6.
14. MacNeil S. Biomaterials for tissue engineering of skin. Mater Today (Kidlington). 2008;11(5):26-35.
15. Hirth DA, Singer AJ, Clark RA, McClain SA. Histopathologic staining of low temperature cutaneous burns: comparing biomarkers of epithelial and vascular injury reveals utility of HMGB1 and hematoxylin phloxine saffron. Wound Repair Regen. 2012;20(6):918-27.
16. Andrade TA, Iyer A, Das PK, Foss NT, Garcia SB, Coutinho-Netto J, et al. The inflammatory stimulus of a natural latex biomembrane improves healing in mice. Braz J Med Biol Res. 2011;44(10):1036-47.
17. Coudroy R, Jamet A, Peñuelas O, Thille AW. Use of Type III procollagen measurement as predictor of lung fibroproliferation in ARDS: early measurement for earlier antifibroproliferative therapy? Intensive Care Med. 2015;41(6):1159-60.
18. Barascuk N, Vassiliadis E, Larsen L, Wang J, Zheng Q, Xing R, et al. Development and validation of an enzyme-linked immunosorbent assay for the quantification of a specific MMP-9 mediated degradation fragment of type III collagen--A novel biomarker of atherosclerotic plaque remodeling. Clin Biochem. 2011;44(10-11):900-6.
19. Modak N, Tamgadge S, Tamgadge A, Bhalerao S. Comparative Study of Clinical Staging of Oral Submucous Fibrosis with Qualitative Analysis of Collagen Fibers Under Polarized Microscopy. Iran J Pathol. 2015;10(2):111-9.
20. Vilela ASB. Matriz extracelular de pericárdio fibroso porcino [Tese de doutorado]. Campinas: Universidade Estadual de Campinas; 2006.
21. Buchaim RL, Rosso MPO, Andreo JC, Buchaim DV, Okamoto R, Rodrigues AC, et al. A New Anionic Bovine Tendon as Scaffold for the Repair of Bone Defects: A Morphological, Histomorphometric and Immunohistochemical Study. Br J Med Med Res. 2015;10 (8):1-11.
22. Yamamoto K, Yoshizawa Y, Yanagiguchi K, Ikeda T, Yamada S, Hayashi Y. The characterization of fish (Tilapia) collagen sponge as a biomaterial. Int J Polym Sci. 2015;2015.
23. Camargo AD, Camargo PC, Leal LM, Garcia Filho SP, Martins LL, Shimano AC, et al. Propriedades tensiométricas do peritônio da paca (Cuniculus paca) a fresco e conservado em glicerina 98%. Pesq Vet Bras. 2014; 34(2):185-91.
24. Hilbig CC, Fockink DH, Maluf MLF, Boscolo WR, Feiden A. Resistência do couro de tilápia e composiçao centesimal da pele nas operaçoes de ribeira e curtimento. Sci Agrar Paranaensis. 2013;12(4):258-66.
1. Professora Doutora do Departamento de Clínica Odontológica, Universidade Federal do Ceará, Fortaleza, CE, Brasil
2. Graduanda em Odontologia, Universidade Federal do Ceará. Fortaleza, CE, Brasil
3. Cirurgiao dentista, aluno do Programa de Pós-graduaçao em Odontologia, Fortaleza, CE, Brasil
4. Cirurgiao dentista, aluno do Programa de Pós-graduaçao em Odontologia, Fortaleza, CE, Brasil
5. Cirurgiao dentista, aluno do Programa de Pós-graduaçao em Odontologia, Fortaleza, CE, Brasil
6. Médico, cirurgiao plástico do Centro de Queimados do Instituto Dr. José Frota e Instituto de Apoio ao Queimado, Fortaleza, CE, Brasil
7. Coordenador Médico do SOS Queimaduras e Feridas, Hospital Sao Marcos, Recife, PE, Brasil
8. Professor Doutor do Departamento de Fisiologia e Farmacologia, Universidade Federal do Ceará, Fortaleza, Ceará, Brasil
Correspondência:
Edmar Maciel Lima Júnior
Rua Visconde de Mauá, 1650 ap. 801 - Aldeota
Fortaleza, CE, Brasil - CEP 60.125-160
E-mail:
edmarmaciel@gmail.comArtigo recebido: 2/10/2015
Artigo aceito: 15/12/2015
Local de realizaçao do trabalho: Universidade Federal do Ceará, Fortaleza, CE, Brasil.